作業で利用するツール、システムやサービス内容は
お客様とご相談の上、設定いたします。


2018年5月5日より、米国ではeCTD形式でのDMF(ドラッグマスターファイル)提出が義務化されます。
既に提出済みのDMFも対象となり、年次報告・変更・Letter of Administrationのみの提出においても、2018年5月5日以降紙媒体での提出は受け入れられません。
米国向けDMFをはじめ、海外当局への各種マスターファイルの電子申請をイーサではサポートしています。
豊富な海外当局への提出経験
米食品医薬品局(FDA)、欧州医薬品庁(EMA)を中心に、その他各主要規制当局へのDMF提出を多数経験。
またDMF以外にも、医薬品の海外承認申請についてもお気軽にご相談ください。
eCTD提出経験のある海外規制当局(2018年1月時点)

申請資料の電子化から提出までのワンストップサービス
各規制当局のeCTD要件を熟知したオペレータにお任せください。
お手持ちの紙資料の電子化からeCTDデータの作成、ゲートウェイシステム等を通じた提出まで、ご要望に応じたサービスを提供します。
エージェントやコンサルタントをお探しであれば、信頼できるパートナー企業をご紹介します。
また新規でのDMF提出に際し、申請書類そのものを一から作成したい場合も、パートナー企業と連携してサポートいたします。
ご利用に適しているお客様
サービスタイプのご案内

これらのサービスは自由に組み合わせて利用できます。
作業で利用するツール、システムやサービス内容は
お客様とご相談の上、設定いたします。
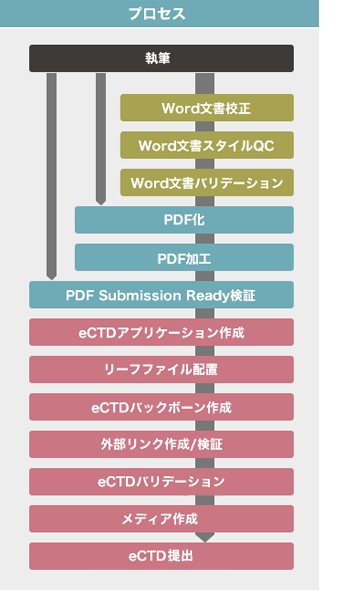
QCサービス
Word文書に対して作業を行います。
各ツール・システムを利用して、リーフファイルを作成するために必要な修正・確認作業を行います。
Publishingサービス
PDF文書に対して作業を行います。
各ツール・システムを利用して、eCTD要件を満たしたリーフファイルを作成いたします。
eCTD作成サービス
各システムを用いて、eCTDの作成を行います。
作成したeCTDは必要な検証を行い、CD-ROM/DVD-ROMにて納品いたします。
Scanサービス
紙文書のスキャン作業を実施いたします。
提出代行サービス
お客様に代わり、ゲートウェイシステムを利用してのeCTD提出を実施いたします。
紹介サービス
エージェントやコンサルタントをお探しのお客様に、弊社パートナー企業を紹介いたします。